东方生物呼吸道三联检产品获美国FDA紧急使用授权 检出准确率居行业前列
近日,东方生物的新冠、甲乙流抗原快速联合检测试剂取得由美国食品药品监督管理局(FDA)批准的新冠、甲乙流抗原快速联合检测试剂(鼻拭子)的紧急使用授权(EUA)。该产品取得EUA后,公司可在美国和认可美国EUA的国家/地区销售。
据美国独立卫生研究所独立试剂评价中心的官方临床数据显示,美国衡健生物制品有限公司所生产的产品灵敏度均达到90%以上、特异性均达到99%以上。事实上,在同样取得FDA EUA的7款呼吸道三联检产品中,该检测产品在灵敏度、特异性、准确性方面均居前列。
三联检产品获美国FDA紧急使用授权
6月17日,东方生物官微的消息,公司全资子公司美国衡健生物科技有限公司取得由美国食品药品监督管理局(FDA)批准的新冠、甲乙流抗原快速联合检测试剂(鼻拭子)的紧急使用授权(EUA)。
尽管新冠疫情不再是“全球卫生紧急事件”,但新冠病毒仍在传播、变异和夺取生命。而甲型、乙型流感病毒或者新型冠状病毒引起的呼吸道病毒感染具有相似的临床表现。为区分不同病毒引起的呼吸道感染,并进行针对性治疗,需要可以检测和区分不同致病病毒的检测产品。在此背景下,多重快速检测解决方案正在兴起。
公告显示,东方生物的新冠、甲乙流抗原快速联合检测试剂可在感染症状出现后的早期用于快速、定性鉴别检测新冠病毒、甲型或乙型流感感染情况。该产品操作简便,准确性高,15分钟内出结果,满足呼吸道疾病反复易感、高发情况下的检测需求。
据了解,本次美国衡健的新冠、甲乙流抗原快速联合检测试剂(鼻拭子)在美国顺利完成性能评估及临床验证,该产品取得EUA后,公司可在美国和认可美国EUA的国家/地区销售。需求者购买无需处方,通过美国的电商、药店、商超等渠道进行销售,预计未来可能为公司带来相关销售收入。
东方生物表示,上述产品获得美国FDA EUA授权,进一步完善了公司在美国市场的重要产品类目,有利于美国市场的整体拓展。不过,上述取证产品的实际销售业绩取决于美国市场的实际检测需求,以及公司在美国市场的实际销售能力和产品竞争实力,目前尚无法预测上述产品对公司未来经营业绩的影响。
临床数据优异 准确率均居前列
目前,市场上呼吸道联检产品以PCR核酸检测和抗原检测为主,PCR核酸的检测病原体种类较多,如呼吸道病原体六项检测、八项检测、十三项检测等。而抗原检测以三联检测为主,目前已有不少IVD抗原企业的联检产品取得CE等证书。
相比之下,FDA EUA认证的“含金量”就高很多。作为世界上最具权威性和影响力的药品和医疗器械监管机构之一,获得FDA认证意味着产品符合FDA的严格标准和要求,且具备高质量,安全性和有效性。
从FDA网站查询来看,目前仅有7款新冠、甲乙流抗原快速联合检测试剂取得了EUA授权,其中,Healgen COVID-19/Flu A&B Ag Combo Rapid Test Cassette (Swab)、WELLlife COVID-19/Influenza A&B Home Test、iHealth COVID-19/Flu A&B Rapid Test Pro三款均为国产。
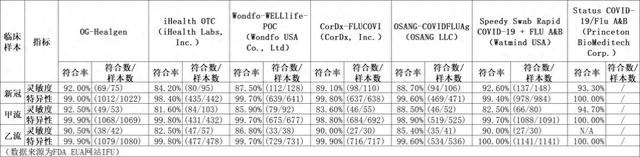
从FDA网站披露的7款产品的产品说明书来看,东方生物的三联检产品对新冠的灵敏度为92%,特异性为99%;对甲流的灵敏度为92.5%,特异性为99.9%;对乙流的灵敏度为90.5%,特异性为99.9%。该产品在灵敏度、特异性、准确性方面均居前列,仅次于Princeton BioMeditech的“Status COVID-19/Flu A&B”。不过,“Status COVID-19/Flu A&B”的相关数据是基于评估,其并没有做临床,产品说明书也未公布样本数。
从临床样本数来看,东方生物的三联检产品对新冠的评估样本数为1097例,对甲流的评估样本数为1122例,对乙流的评估样本数为1122例。该产品是同类产品中,“唯二”评估样本数均超千例的产品。
在业内看来,东方生物的呼吸道三联检产品已验证了具备良好的性能,本次取得FDA EUA认证不仅为产品赋予了合规性和可靠性,还增加了消费者和医疗机构的信任度,有助于在市场上获得竞争优势。此外,许多国家和地区也将FDA认证作为市场准入的重要要求,本次获得FDA EUA认证将为开拓国际市场提供便利。